华东理工大学饱和环胺扩环反应研究获进展
近日,华东理工大学化学与分子工程学院、费林加诺贝尔奖科学家联合研究中心陈宜峰教授课题组在《自然•化学》上发表了研究文章,在线报道了课题组非张力饱和环胺的多样化环扩张反应的研究新进展。
多样性导向合成(Diversity-Oriented Synthesis,DOS)的核心目标是通过简单的起始原料构建出复杂且多样化的有机化合物,这一理念在合成化学中具有重要意义。饱和环胺是天然产物和生物活性化合物中广泛存在的结构基元。围绕含氮杂环的多样性合成,开发新型的方法学一直是有机化学和药物化学领域的重要研究目标。与传统的从头合成含氮杂环方法相比,直接利用现存数量庞大的饱和含氮杂环分子库,通过骨架编辑快速生成具有不同环尺寸的多样化类似物,可以显著提升结构-活性关系的研究效率。近年来,基于饱和环胺的α-官能化、远端直接官能化反应已被广泛报道,但对其直接骨架编辑面临着巨大挑战。尽管近期一些研究报道了饱和环胺的开环、氮原子消除、缩环反应等,这些转化的目标产物通常不再包含氮杂环结构。因此,将饱和环胺转化为扩环后的含氮杂环,同时保持其原有功能性,依然是一项长期存在的挑战。
早期的研究主要集中在利用高张力的氮杂环丙烷或氮杂环丁烷进行环加成反应。而现有的分子间扩环方法则主要针对非饱和碳-碳键或碳-杂原子键,例如经典的Baeyer-Villiger氧化、Beckmann重排、Buchner反应、卡宾或卡拜插入等。然而,将易获得的五元或六元饱和环胺直接扩环为结构多样化的类似物仍然面临诸多挑战。近日,陈宜峰课题组开发了将甘氨酸衍生物作为两个碳合成子直接插入五元或六元饱和环胺的方法,利用借氢策略,实现了串联钌催化C-C键形成、逆-氮杂迈克尔加成和内酰胺化过程,构建出七元内酰胺类衍生物,实现了形式上的[5+2]反应。进一步对产物进行衍生化,可以在脂肪环上模块化插入碳一或碳二单元,最终将一个氮杂环转化为多达五种不同的氮杂环。该技术为现有候选药物的多样化合成提供了一个前景广阔的平台。
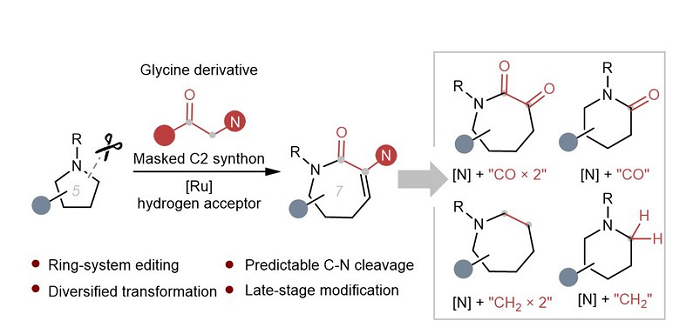
图片说明:研究总览
该工作主要由华东理工大学化学与分子工程学院吴利城博士和博士研究生夏含玉完成,通讯作者为陈宜峰教授,并得到了曲景平教授的悉心指导。


